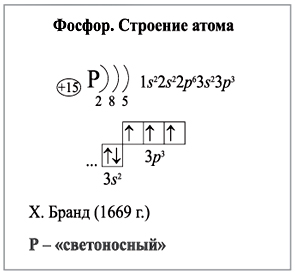
Схема строения атома фосфора

Не летуч. Задача 1 1 г — из ядра и электронов 2 в — протоны и нейтроны 3 б — 20 4 а — заряду ядра атома 5 в — магний. Следовательно, число электронов равно 7. Регистрация Вход.
Фосфор проявляет восстановительные свойства в реакциях с кислородом, галогенами и серой. Фосфор легко окисляется кислородом , при этом в недостатке кислорода образуется оксид фосфора III , а в избытке — оксид фосфора V :. Фосфор окисляется концентрированными азотной и серной кислотами до ортофосфорной кислоты:.
Эта реакция происходит при поджигании спичек:. Окислительные свойства фосфора :. В отличие от азота, фосфор непосредственно не взаимодействует с водородом. Реакции диспропорционирования фосфора :. Получение фосфора. В качестве восстановителя соединений фосфора используют кокс углерод. Процесс проводят в электропечах производство относят к электротермическим без доступа воздуха. Из-за наличия примесей технический фосфор имеет жёлтый цвет, поэтому в промышленности его называют жёлтым фосфором.
Применение фосфора. Фосфор применяют для получения препаратов, которые используют для уничтожения насекомых-вредителей. Красный фосфор используют в производстве спичек в составе массы, наносимой на боковую сторону спичечной коробки. Чёрный фосфор применяют очень редко. Биологическая роль фосфора. Фосфор — биогенный элемент, он играет важную роль в процессах накопления и освобождения энергии в клетках, задействован в передаче нервных импульсов.

Фосфор входит в состав нуклеиновых кислот, участвующих в процессах роста и деления клеток, хранения и использования генетической информации ДНК и РНК. Фосфор обеспечивает нормальную и здоровую структуру дёсен и зубов. Коротко о главном. Фосфор может существовать в виде нескольких аллотропных модификаций, наиболее известными из которых являются белый, красный и чёрный фосфор, которые различны по строению и свойствам.
Окислительные свойства выражены у фосфора слабее, чем у азота. Фосфор играет важную роль в процессах жизнедеятельности живых организмов. Вопросы для самоконтроля. Охарактеризуйте электронное строение атомов фосфора. Сравните электронное строение атомов фосфора и азота; отметьте сходство и различие. Поясните, почему фосфор в химических реакциях способен проявлять как окислительные, так и восстановительные свойства. Аргументируйте ответ. Приведите примеры соответствующих уравнений реакций.
Это интересно. Такие спички легко зажигались от трения о шероховатую поверхность. Однако при горении они создавали неприятный запах, и, главное, их производство было весьма вредно для рабочих.
Вдыхание паров белого фосфора приводило к тяжелейшему заболеванию — фосфорному некрозу костей. Сохранились воспоминания бывшей работницы одной из спичечных фабрик А. Коревановой, в которых она пишет: «В фосфорном цехе варили фосфор для спичек. Когда фосфор кипит, то бурлит, и одновременно выходит вонючий газ. Не только около рабочего, но даже около костюма его, где он висит, нельзя пройти, а ночью костюм огнём светится».
От газа у рабочих дрябли кости, носы проваливались. Азот как простое вещество состоит из двухатомных молекул N 2 , графическая формула молекулы азота. Действительно, в подавляющем большинстве реакции с участием азота протекают в «жёстких условиях» при очень высоких температурах и давлениях. Физические свойства. Азот — газ н. Химические свойства.
Азот в реакциях с кислородом и фтором проявляет свойства восстановителя, а с металлами и водородом — окислителя. Азот как восстановитель. Реакция является эндотермической. При этом образуется оксид азота II :. Азот как окислитель. Реакция азота с водородом протекает при высокой температуре и давлении даже в присутствии катализаторов:. Реагируя с металлами при повышенной температуре , азот образует бинарные соединения нитриды:. Азот получают в промышленных масштабах из сжиженного воздуха, в лаборатории в небольших количествах — разложением нитрита аммония:.
Основная область применения азота — производство аммиака. Его используют также для создания инертной среды при хранении пищевых продуктов, произведений искусства и рукописей, в пожаротушении, лазерной резке металлов. Расширяется спектр его применения в медицине и косметологии, например криоконсервация клеток, криотерапия удаление папиллом и гемангиом.
Фосфор, являясь элементом VА-группы , как и азот, способен образовывать молекулу состава P 2. Однако, в отличие от молекулы азота, двухатомная молекула фосфора неустойчива. Поэтому фосфор существует в виде нескольких аллотропных модификаций, в которых реализуются лишь одинарные связи Р—Р : фосфор белый, красный, чёрный и другие табл. Таблица Строение и физические свойства аллотропных модификаций фосфора. Белый фосфор Р 4 представляет собой воскообразное вещество с чесночным запахом, ядовит.
На воздухе в темноте светится зеленовато-жёлтым цветом в результате медленной химической реакции окисления хемилюминесценция рис. Красный фосфор — аморфное вещество полимерного строения, не имеет запаха, его токсичность невысокая. Между аллотропными модификациями фосфора возможны взаимопревращения, протекающие при определённых температурах и давлениях.
Как окислитель фосфор при нагревании вступает в реакции с металлами , образуя фосфиды:. Как восстановитель фосфор реагирует с кислородом и другими сильными окислителями.
В чистом кислороде и на воздухе фосфор ослепительно горит, образуя белый дым частицы твёрдых оксидов фосфора :. Белый фосфор может самовоспламеняться на воздухе, а красный загорается лишь при поджигании, что объясняется различной прочностью химических связей между атомами фосфора в аллотропных модификациях.
К примеру, атом водорода имеет массу всего лишь 1,67х10 г. Вес атома принято измерять в атомных единицах массы. Получается, что 1 а. Например, ядро атома водорода состоит из 1 протона, следовательно, его масса равна 1 а. Атомы состоят из ядра и электронов, которые иногда называют «электронным облаком».
Атомное ядро состоит из протонов и нейтронов. Электрон происходит от греческого слова «янтарь», был открыт в году представляет собой отрицательно заряженную частицу. Электроны движутся по электронным оболочкам. Протон от греческого — первый, открыт в году — частица ядра, имеющая положительный заряд. Нейтрон от латинского «ни тот, ни другой», открыт в году — элемент ядра, не имеющий заряда.
Протоны и нейтроны вместе называют также нуклонами ядерными частицами. Атомы различаются по количеству протонов и нейтронов в ядре. В зависимости от количества протонов атом имеет соответствующий номер в Периодической системе Менделеева и относится к некоторому химическому элементу. Число нейтронов в ядре атома указывает на изотоп данного элемента. Изотопами называют разновидности атомов одного химического элемента, которые имеют одинаковый атомный номер, но различные массы.
Атом является электрически нейтральным, поскольку положительный заряд ядра равен сумме отрицательных зарядов электронов, вращающихся вокруг ядра. Их движение происходит по электронным оболочкам. Количество электронов и электронных оболочек зависит от величины заряда ядра атома. Схема строения атомов наглядно представлена в Периодической системе химических элементов. Возьмем в качестве примера химический элемент натрий. Символ элемента обозначается латинскими буквами Na. Название записывается русскими буквами — натрий.
Атомная масса элемента атомный вес, относительная атомная масса — это суммарная масса нейтронов, протонов и электронов в атоме, выраженная в а. У Na она Электронная конфигурация атома Na записывается так: 1s 2 2s 2 2p 6 3s 1 , где 1s — первый энергетический уровень, на котором располагаются 2 электрона на s-электронной орбитали; 2s и 2p — второй энергетический уровень, где находятся 2 электрона на s-электронной орбитали и 6 электронов на p-электронной орбитали; 3s — третий энергетический уровень, где находится 1 электрон на s-электронной орбитали.
В истории науки были разработаны различные модели строения атома. В году Джон Дальтон предложил сферическую модель, которая изображала атом в качестве мельчайшей материальной сферы, не поддающейся разрушению. В году Джозеф Томпсон создал модель, получившую название «Пудинг с изюмом».

В этой модели атом рассматривался как определенное положительно заряженное тело, содержащее внутри себя отрицательно заряженные электроны. В году Эрнест Резерфорд на основании проделанных опытов пришел к выводу, что атом напоминает маленькую планетную систему, где вокруг ядра по орбитам вращаются электроны.
Однако планетарная модель входила в противоречие с принципами классической электродинамики, в соответствие с которыми движущиеся электроны должны терять энергию и упасть на ядро. Современная модель атома получила название квантово-механической.