Электронное строение атома серы, Физические и химические свойства серы. Оксиды серы

Оксид серы представляет собой газ с резким запахом, бесцветный, тяжелее воздуха, хорошо растворяется в воде. FeS2 — серный или железный колчедан, пирит. Все что нужно, чтобы сделать домашнее задание!
Серу накапливают бактерии, перерабатывающие сероводород.
Сера — активный элемент, реагирующий при нагревании практически со всеми элементами, кроме инертных газов и N 2 , I 2 , Au, Pt. Сера не взаимодействует с соляной кислотой. Основные реакции серы с элементами описаны в таблице.
Сера — кристаллический неметалл жёлтого цвета. Известно 24 изотопа серы.
Это активный элемент, вступающий в реакцию с металлами и неметаллами. Образует соли — сульфиты и сульфиды, а также серную кислоту. Сера нерастворима в воде и соляной кислоте. Входит в состав живых организмов. В природе находится в свободном и связанном виде.
Строение атома серы. Приветствую вас, уважаемые читатели, на своем канале! В данной статье разберем основное и возбужденное состояния атомов и электронные формулы ионов.

Предыдущие статьи по вопросу 1 можно посмотреть здесь:. Основное и возбужденное состояния атомов. Валентность - это способность атома химического элемента образовывать с другими атомами химические связи за счет отдачи или принятия электронов. Валентность определяется числом неспаренных электронов в обычном и возбужденном состоянии атома.
Когда мы строим электронные конфигурации атомов по ПС, то это основное состояние то есть состояние с минимальной энергией. Иногда, некоторые атомы, когда получают энергию извне, могут переходить в возбужденное состояние. Возбужденное состояние атома - это состояние, при котором электрон из электронной пары с предыдущего подуровня с меньшей энергией "расспаривается" и переходит на следующий подуровень с большей энергией.

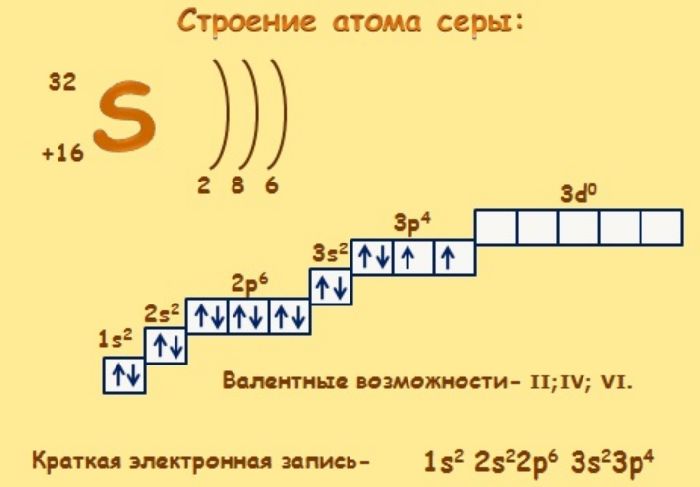
Например, рассмотрим электронные оболочки атомов углерода и серы в основном и возбужденном состояниях. Возбужденное состояние характерно для таких атомов, которые имеют свободную орбиталь. Например, мы знаем, что третий уровень характеризуются тремя подуровнями, независимо от их заполнения например, как у серы. Атомы азота N , кислорода O , фтора F и неона не могут переходить в возбужденное состояние, так как нет свободных орбиталей и второй уровень характеризуется только двумя подуровнями.
Атом азота N :. Рассмотрим три реакции, в которых сера проявляет разные валентности:. В основном не возбужденном состоянии сера двухвалентна. В реакции с атомами водорода она образует соединение H 2 S потому, что у нее на двух p-орбиталях из трех имеющихся находится по одному электрону, и остается место для спаривания еще с двумя "чужими" электронами водородных атомов.
Однако, в отличие от атомов водорода или кислорода, у которых валентные электроны находятся на 1-м и 2-м уровнях где нет d-подуровней , валентная оболочка серы имеет пустой 3d-подуровень.
Этот 3d-подуровень находится достаточно близко по энергии к внешнему 3p-подуровню атома серы. При поглощении даже небольшой порции энергии один из 3p-электронов может переходить на 3d-подуровень рис. Затрата энергии при этом с лихвой покрывается выигрышем при образовании дополнительных ковалентных связей. Переход атома серы из основного состояния с валентностью II в первое возбужденное состояние с валентностью IV.
Таким образом, на внешнем уровне возбужденного атома серы оказывается уже 4 неспаренных электрона. Эти 4 электрона могут быть предоставлены двум атомам кислорода для образования молекулы SO 2.
Дальнейшее возбуждение атома серы которое требует уже гораздо больше энергии ведет к переходу одного из 3s-электронов на 3d-уровень рис. В результате атом серы получает шесть неспаренных электронов, которые предоставляются уже трем атомам кислорода для образования молекулы SO 3. Возникает вопрос: соблюдается ли правило октета в молекулах SO 2 и SO 3? На первый взгляд, у атома серы оказывается избыток 10 и 12 электронов и такие молекулы не должны быть стабильными. В чем же дело? Можно предположить, что в молекуле SO 2 кислород оттягивает с внешней оболочки атома серы именно столько электронов, сколько нужно для того, чтобы сделать ее похожей на октетную оболочку.
Это можно показать даже с помощью структурных формул:. В каждой из таких "крайних" структур одна "лишняя" электронная пара всегда целиком сдвинута к одному из атомов кислорода. Реальная молекула, как полагают, является чем-то средним между этими двумя крайними структурами.