Сахароза cu oh 2

Домашняя школа. Химические свойства. Бензол отличается от гексана по замерзанию в ледяной воде у С 6 Н 6 т. При добавлении раствора сахарозы к осадку гидроксида меди II он растворяется; жидкость окрашивается в синий цвет.

Кристаллическое вещество, хорошо растворимое в воде, более сладкое, чем глюкоза. В свободном виде содержится в мёде и фруктах. Химические свойства фруктозы обусловлены наличием кетонной и пяти гидроксильных групп. Дезоксирибоза бесцветное кристаллическое вещество, хорошо растворимое в воде. В виде фуранозной формы входит в состав ДНК. Как и другие моносахариды, дезоксирибоза в растворе существует в ациклической и циклической формах, способна образовывать простые и сложные эфиры, принимает участие в ОВР и реакциях комплексообразования.
Рибоза бесцветное кристаллическое вещество, хорошо растворимое в воде. В виде фуранозной формы входит в состав РНК. Химические свойства рибозы обусловлены наличием альдегидной и гидроксильных групп.
В растворе рибоза существует в ациклической и циклической формах: Получают рибозу гидролизом мононуклеотидов.
Наиболее изученными олигосахаридами являются дисахариды, которые широко распространены в природе. Они содержатся во многих плодах и овощах, сахарной свекле, сахарном тростнике, меде. Дисахариды получают из природных источников: сахарозу из сахарной свеклы или сахарного тростника, мальтозу ферментативным гидролизом крахмала, лактозу из коровьего молока, целлобиозу гидролизом целлюлозы.
Дисахариды бесцветные кристаллические вещества, хорошо растворимые в воде исключение составляет лактоза , сладкие на вкус. Различают два вида дисахаридов. Простые эфиры гликозиды , образующиеся за счет взаимодействия полуацетального гидроксила одной из молекул моносахарида и одного из спиртовых гидроксилов чаще всего у четвертого атома углерода другой молекулы:Молекула образующегося при этом дисахарида содержит один полуацетальный гидроксил и способна переходить в ациклическую альдегидную форму.
Подобные дисахариды способны восстанавливать такие вещества, как Ag2O, Cu OH 2, за что их называют восстанавливающими сахарами. К восстанавливающим сахаром относятся также целлобиоза и лактоза Простые эфиры образуются за счет взаимодействия двух полуацетальных гидроксилов:Дисахариды этого типа не дают реакцию серебряного зеркала и не восстанавливают гидроксид меди II , поэтому их называют невосстанавливающими сахарами.
Дисахариды, как и моносахариды, способны образовывать простые и сложные эфиры. Характерной особенностью дисахаридов является их способность взаимодействовать с гидроксидами металлов Са ОН 2, Сu ОН 2 с образованием хорошо растворимых комплексных соединений сахаратов см. В кислой среде дисахариды легко гидролизуются с образованием одинаковых мальтоза, целлобиоза или различных лактоза, сахароза моносахаридов см. Наибольшее значение имеют производные глюкозы: крахмал и целлюлоза.
Крахмал белый порошок, нерастворимый в холодной воде, в горячей воде набухает, образуя крахмальный клейстер. Амилоза представляет собой линейный биополимер, состоящий из остатков глюкозы, соединенных через кислородные атомы в положении 1 и 4.
Молекулярная масса амилозы от до а. Амилопектин это биополимер, состоящий из остатков глюкозы, соединенных через кислородные атомы в положении 1 4 и 1 6. Сахароза имеет высокую растворимость. Не растворима в диэтиловом эфире. Малорастворима в метаноле. Химические свойства Химическими особенностями сахарозы является то, что она не проявляет восстанавливающих свойств, не проявляет свойств альдегидов и кетонов.
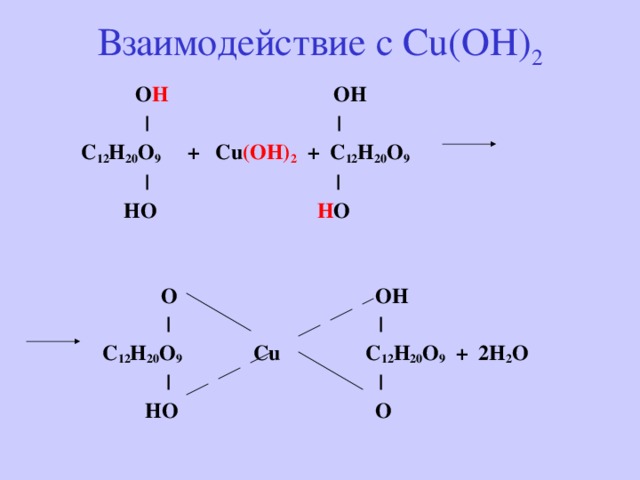
Реакция сахарозы с гидроксидом меди II В молекуле сахарозы имеется несколько гидроксильных групп. Поэтому соединение взаимодействует с гидроксидом меди II аналогично глицерину и глюкозе.
При добавлении раствора сахарозы к осадку гидроксида меди II он растворяется; жидкость окрашивается в синий цвет. Но, в отличие от глюкозы, сахароза не восстанавливает гидроксид меди II до оксида меди I. Технологии личностно ориентированного обучения в полной мере соответствуют современным требованиям.
В них профессиональная позиция учителя состоит в том, чтобы знать и уважительно относиться к любому высказыванию ученика по содержанию обсуждаемой темы.
Педагог продумывает не только то, какой материал сообщать, но и предугадывает, что из этого материала уже имеется в субъектном опыте учащихся.
При этом обсуждать детские версии необходимо в равноправном диалоге. Выделять и поддерживать версии, соответствующие теме урока, задачам и целям обучения. B таких условиях ученики стремятся быть услышанными, активно высказываются по обсуждаемой теме, предлагают, не боясь ошибиться, свои варианты. Обсуждая точки зрения учеников на уроке, учитель формирует коллективное знание, a не просто добивается от класса воспроизведения готовых образцов.
Взаимодействие в процессе урока требует не только учета личностных особенностей, но и особенностей межгруппового взаимодействия, предвосхищения возможных изменений в организации коллективной работы класса, коррекции их по ходу урока. Результативность урока определяется обобщением полученных знаний и умений, оценкой их усвоения, анализом результатов групповой и индивидуальной работы, особым вниманием к процессу выполнения заданий, а не только к конечному результату, обсуждением в конце урока того, что «мы узнали», что понравилось не понравилось и почему.
Усвоение учащимися строения, свойств, способов получения сахарозы, ее биологической роли; развитие умений работать с учебником и дополнительной литературой, применять имеющиеся знания в новых, нестандартных ситуациях, делать выводы; развитие интереса к истории и новым фактам науки, бережного отношения к природе и своему здоровью.
Оборудование и реактивы. Учебник Л. Цветкова «Химия», таблицы «Промышленный способ получения сахарозы», «Строение молекулы сахарозы», «Карта независимого расследования»; сахароза, вода, серная кислота конц.
У доски: характеристика свойств и строения глюкозы. По карточкам. Как данный углевод относится к аммиачному раствору оксида серебра? Вычислить объем СО 2 н. Учитель сообщает тему урока и ставит перед учащимися цель. Необходимо провести расследование по определению строения, свойств, способов получения сахарозы, ее биологической роли, начала истории «сладкой» жизни.
Для получения достоверных сведений мы создадим группы. Каждая группа получает инструкцию, необходимое оборудование и литературу для своего расследования. Подготовьте справку об истории «жизни» сахара, нахождении и образовании его в природе, пользуясь учебником и дополнительной литературой.
2 = C6H12O7 + Cu2O + H2O)